令和2年度、基礎学力テスト理科の問題分析(5)

理科の問題分析ラストの5回目は、
今回一番難しかった中2化学の大問6!
できるだけ簡単になるように解説を書いてみます。
さぁ、最後だ、頑張るぞー!
どーも、塾講師歴18年、38歳3児のパパで認定心理士、上位公立高校受験・国公立大学受験専門塾、じゅくちょー阿部です。
- 本年度の入塾生は、満席となりました。
- 来年度の春期講習会からのご入塾のご予約は10名(仮)の予定です。
- 日曜セミナー『国公立大学:二次対策化学・物理・生物』は、10月4日(日)から全8回で開講します。
大問6<化学>:マグネシウムと銅の化合
(3)(4)の計算問題が何のことやらチンプンカンプンという場合は、
小学校の「割合」の概念、「比」の概念、
もしくは、「和差積商」の概念も危ういと考えられます。
いったん、小学校の算数まで帰っていただいてから、
学力の土台を構築していきましょう。
(1)は、化学反応式を答える問題。
マグネシウムを空気中で加熱すると酸化マグネシウムになる。このときの、化学変化を化学反応式で表せ。
これは、簡単でした。
「2Mg + O2 → 2MgO」
これでOKですね!
(2)は、知識問題。
酸化マグネシウムは何色か?
ア:赤褐色 イ:赤色 ウ:黒色 エ:白色
色を問われる問題は、特殊なものが多くなります。
加熱後に、「白色」になるのは常識的には珍しいですよね?
酸化銀の分解後の色も、白色になります。
セットで覚えておきましょう。
ということで、答えは「エ:白色」です。
(3)は、質量比を使った計算問題。
〜、0.63gのマグネシウムを十分に加熱したときにできる、酸化マグネシウムの質量は何gか?
下の作図をみてみましょう。
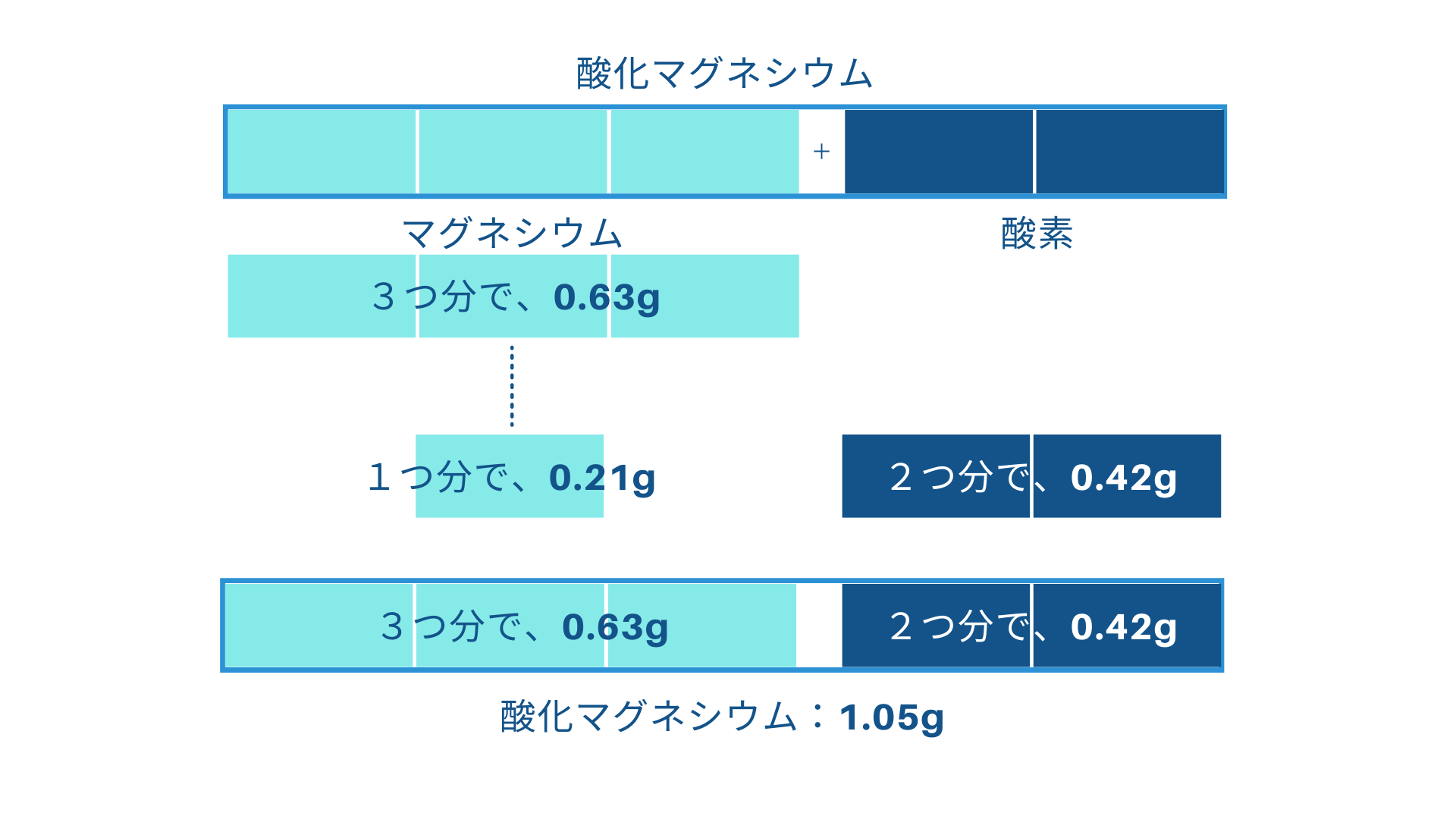
このような作図で考えると、完全に小6算数となります。
概念が分かっているとはこういうことです。
答えは、「1.05g」となりますね。
(4)も、質量比を使った計算問題。
1班が2回目の加熱をし終えた時点で(0.18gのマグネシウムが0.28gになった)、反応せずに残っているマグネシウムの質量は何gか。
下の作図をご覧ください。

ここで大切になるのは、「0.18gのマグネシウムが0.28gになった」
という言葉から、何を情報として受け取るかです。
酸素が「0.10g」増えたということが分かればいいのです。
あとは、「3:2」で反応するマグネシウムと酸素の質量比から
「反応したマグネシウム」の量を出すだけです。
ということで、反応せずに残っているマグネシウムは「0.03g」ですね。
(5)は、最高難度の質量比の問題。
上記のような作図で解説すると、逆に難しくなります。
悔しいですが、この問題は方程式を作って考えた方が楽です。
そして、方程式のレベルであれば中1の標準レベルの問題となります。
マグネシウムの粉末と銅の粉末の混合物を2.16g準備し、ステンレス皿の上で十分加熱したところ、加熱後の質量は2.80gであった。混合物に含まれていたマグネシウムの質量は何gか。
マグネシウムの質量をxとおきます。
問題の条件から分かることは、マグネシウムと銅に結びついた酸素の量。
2.80g-2.16g=0.64g
銅と酸素の質量比は、「4:1」。
マグネシウムと酸素の質量比は、「3:2」。
方程式は、
\frac{1}{4}(2.16-x) + \frac{2}{3}x = 0.64
途中式は省きます。
x = 0.24[g]
となります。
最後の問題は、方程式を使えば解けると気づけば
なんのことは無い問題でした。
ですが、その発想の転換をテスト中に気づけるかということが
思考力・判断力・表現力を求める新時代の問題だと考えます。
第二回の基礎学の「化学」予想!?
第二回の範囲は、中3化学の「イオン」が含まれます。
よって、まずは「イオン」の対策をすることが大切でしょう。
ですが、「化学」は他の分野と違います。
それは、中1からの「化学」から全てつながっているということです。
ですから、中2の化学が苦手になっている場合、「イオン」を突破することは
非常に難しいものとなるでしょう。
「化学」対策だけは、中1からの化学のやり直しをお勧めします。
遠回りだと感じるかもしれませんが、それが最短の対策となりますよ!
ちゃん♪ちゃん♫
2020年度『つばさ』の授業日程は、ここからご確認できます。

.png)




