『2021年度 第二回基礎学「理科」の問題分析(4)』
大学入試共通テストまで、あと48日!
公立高校入試まで、あと100日!
第三回基礎学力テストまで、あと45日!
中学校別:基礎学平均点情報ページは、コチラ!
出版記念セミナー:「高校受験への解決策」詳細はコチラ!
公立高校入試まで、あと100日となりました!
本日も化学の分析を進めてまいりましょう!
内容は中3の化学範囲であるイオンの中和反応でした。
化学で点数としての結果を出すためには、
設問文を読み解く必要があります。
なぜなら、解くためのヒントが記述されているからです。
かなり長い文章になりますが、
設問を詳細に読み書かれている情報・条件から
「ってことは?」という情報を導き出せるかどうかで
化学が解けるようになるかが決まってきます!
大問6 中3化学 イオン:中和反応
水酸化バリウム水溶液にうすい硫酸を少しずつ加える[実験]を行い、そのときの反応をモデルで考えた。図1は、[実験]で水酸化バリウム水溶液10㎤にうすい硫酸を2㎤ずつ加えていくときの液体に含まれる粒子について、水酸化バリウム水溶液に含まれるイオンを◯, ●, 硫酸に含まれるイオンを□, ■, 反応によってできた物質をA, Bで示したものである。次の問いに答えなさい。
[実験]
① 水酸化バリウム水溶液を10㎤メスシリンダーで測りとり、ビーカーに入れた。これにフェノールフタレイン溶液を2, 3滴加えると、液体の色は赤色になった。
② ①にうすい硫酸を少しずつ加えてガラス棒でかき混ぜ、液体の変化を観察すると、白い沈澱ができた。硫酸をちょうど4㎤加えたところで、ビーカー内の液体の赤色が消えた。
③ ビーカー内の液体の赤色が消えた後も、しばらく硫酸を加え続け観察した。表1は、このときの結果を示したものである。
(1)図1について、○, ●, □, ■ にあてはまるイオンの組み合わせとして正しいものを次の a〜d から1つ選べ。
これも、単純な知識を問う問題ではありません。
まずは、硫酸と水酸化バリウムが電離して、
どのようなイオンへと別れるかという点。
硫酸は、H+の陽イオン2つと、SO42-の陰イオン1つに。
水酸化バリウムは、OH–の陰イオン2つと、Ba2+の陽イオン1つに。
それぞれの物質は1:2の割合で陽イオンと陰イオンに分かれる点。
結果的に、この知識を図で示された内容と照らし合わせる点。
よって、「◯:OH–」、「●:Ba2+」、「□:H+」、「■:SO42-」。
答えは、「イ」ですね。
三つの知識と情報のつなぎ合わせで解答にたどり着けます。
(2)図1のA, Bは、水酸化バリウム水溶液と硫酸の反応によってできた物質を表している。それぞれの物質名を書け。
まず、知識の確認をしておきましょう。
この知識がなければ解けませんから。
水に溶けて電離したときに、H+を発生させる物質のことを「酸」といいます。
水に溶けて電離したときに、OH–を発生させる物質のことを「アルカリ」といいます。
この「酸」と「アルカリ」を混ぜ合わしたときに、H+とOH–が結びつきH2Oができる反応のことを『中和』といいます。
このとき、H+とOH–以外の陽イオンと陰イオンが結びついてできた物質のことを「塩(=えん)」といいます。
ということは、この問題は「中和によってできた物質」と、「塩」を答えよ、という意味になります。
解答は、「水」と「硫酸バリウム」となりますね。
一つ一つの問題が、知識と意味を結びつけて解答をたどっていかなければ解けない問題となっている印象ですね。
(3)図1のア〜エについて、中和が起こっているものを全て選べ。
やはり良問です!
言葉の知識だけでなく、実際の現象としても理解できているかを問う問題です。
何回でもシビれてしまいますね(笑)
再度確認します。
この「酸」と「アルカリ」を混ぜ合わしたときに、H+とOH–が結びつきH2Oができる反応のことを『中和』といいます。
ということは、水溶液が「中性」となってしまってからは、「中和」は起きないのです。
設問文の黄色の下線部から、「水酸化バリウム10㎤」と「硫酸4㎤」で完全に中和し、
水溶液が中性となります。
よって答えは、「ア、イ」ですね。
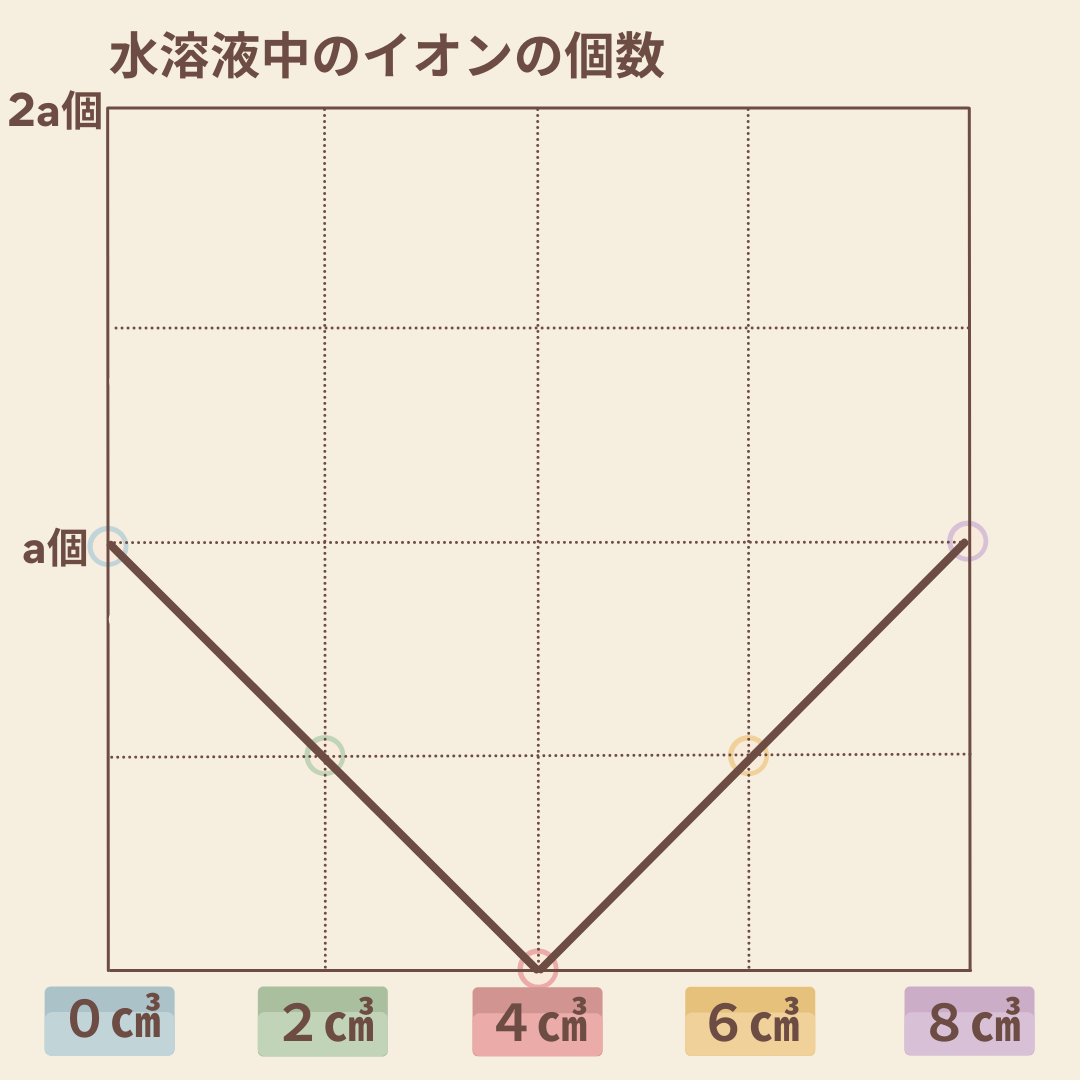
(4) [実験]における加えた硫酸の体積と、ビーカー内の液体に含まれるイオンの数の合計との関係を表すグラフを解答用紙にかけ。ただし、このとき用いた水酸化バリウム水溶液10㎤に含まれるイオンの数をa個とする。
これの問題も、良問です。
与えられたデータを整理しグラフへの変換を求める問題となりました。
そして、この問題が塩酸と水酸化ナトリウムでの中和反応の問題でないことが、
水溶液中の個数をグラフで表す少し難しい点だと言えるでしょう。
塩酸と水酸化ナトリウムの中和によってできる塩は、「塩化ナトリウム(=食塩)」。
食塩は、水の中では結晶化せず、イオンのまま存在するので
グラフ化する際に少しコツが必要となります。
硫酸と水酸化バリウムの塩である硫酸バリウムは、
中和が行われた瞬間に塩ができ、白色の沈澱となって目に見えます。
よってこの実験においては、硫酸を足すことによって
一気にイオンから物質へと変わっていくことが注目すべき点となります。
解答は以下のようなグラフとなりますね。
(5) 図1のビーカー①〜⑤の水溶液について、電流が流れるかどうかを調べたとき、電流が流れないビーカーはどれか、①〜⑤から1つ選べ。また、そう考える理由を書け。
そもそも、電流が水溶液に流れない状況とはどのような条件下なのでしょうか?
まず水には、何かしらの電解質の物質が溶けています。
端的に言えば、陽イオンと陰イオンが種類を問わず溶けている状態です。
このときに、電流は流れる状態になります。
ということは、陽イオンと陰イオンが溶けていない条件下で
電流が流れないということになります。
よって、完全に中和状態である「③」が答えとなり、
理由としては「電離したイオンが水溶液中に含まれないから」
でオッケーですね!
とにかく良問揃いの中3化学でした。
怒涛の土曜日は大忙しです(汗)
無理のないペースで更新をしていきま〜す!
ちゃん♪ちゃん♫
学校







